问题
计算题
某工业碳酸钠样品中混有少量氯化钠,为了测定样品的纯度,向12.0g样品中滴加稀盐酸至恰好完全反应,待二氧化碳气体不再放出后,去除溶液中的水分,最终得到13.1g氯化钠固体。试计算工业碳酸钠样品中Na2CO3的质量分数。(结果精确到0.1%)
答案
88.3%
题目分析:稀盐酸与碳酸钠反应会生成氯化钠,即最终得到13.1g氯化钠固体包括两个部分:样品中原有的和生成的氯化钠,可通过假设未知数通过化学方程式利用物质反应的质量比求出样品中碳酸钠的质量。
【解】设:12g样品中含Na2CO3的质量为x,反应生成氯化钠的质量为y。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117
x y
106 /x =" 117" /y
y =" 117x" / 106
所得固体氯化钠的质量:12g-x+117x/106=13.1g
x=10.6g
该样品中含Na2CO3的质量分数为:10.6/12×100% = 88.3%
答:工业碳酸钠样品中Na2CO3的质量分数是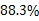 。
。
