某石灰石样品的成分是CaCO3和SiO2(已知SiO2既不溶于水也不与盐酸反应)。课外小组为了测定该石灰石样品中碳酸钙的质量分数,将12.0g石灰石样品放入烧杯中,再取100 g稀盐酸分4次加入烧杯中,每次均充分反应。实验数据记录如下:
| 次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| 加入稀盐酸质量 /g | 25 | 25 | 25 | 25 |
| 反应后烧杯中物质的总质量 /g | m | 58.4 | 82.6 | 107.6 |
求:(1)生成二氧化碳的总质量是 g。
(2)第1次加入稀盐酸充分反应后,烧杯中物质的总质量是 g。
(3)该石灰石样品中碳酸钙的质量分数。(写出计算过程)
⑴4.4g ⑵35.2g ⑶83.33%
题目分析:⑴四次后,如果不考虑产生气体的逸出,烧杯中共应有物质100g+12g=112g,但由于产生二氧化碳气体逸出烧杯,所以烧杯中只剩下107.6g物质,由此可知产生气体为112g-107.6g=4.4g。
⑵第3次在烧杯中原有58.4克物质的基础上再加入25克稀盐酸,充分反应后烧杯中物质总质量不是58.4+25=83.4克,而仅剩余82.6克,可知第3次加入盐酸后仍反应产生二氧化碳气体。进一步可知第2次反应完成后仍有碳酸钙剩余。到第2次结束 * * 生二氧化碳气体12+25+25-58.4=3.6g。由于每次加入稀盐酸量相同,则每次产生二氧化碳量也应相同,故第一次反应完成后产生二氧化碳气体1.8g。由此可算出反应后剩余物质量m。具体如下:12+25-1.8="35.2g" 。或者也可以m+25-1.8=58.4g,求出m=35.2g。
⑶由于碳酸钙全部反应完 * * 生二氧化碳4.4g,据此可计算出碳酸钙的质量,并将之除以样品质量即得结果。具体计算过程如下:
解:设碳酸钙质量为X
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
X 4.4g
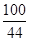 =
= 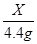
X=10g
碳酸钙的质量分数为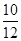 ×100%=83.33%
×100%=83.33%
