已知某浓度的硫酸在水中的电离方程式:
H2SO4====H++HSO-4,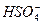
 H++
H++ 。
。
(1)Na2SO4溶液显________(填“酸性”“碱性”或“中性”),理由是(用离子方程式表示)_________。
(2)在25 ℃时0.1 mol·L-1的NaHSO4溶液中c( )="0.029" mol ·L-1,则25 ℃时,0.1 mol·L-1 H2SO4溶液中c(
)="0.029" mol ·L-1,则25 ℃时,0.1 mol·L-1 H2SO4溶液中c( )________(填“大于”,“小于”或“等于”)0.029 mol ·L-1,理由是__________。
)________(填“大于”,“小于”或“等于”)0.029 mol ·L-1,理由是__________。
(3)在0.1 mol ·L-1 Na2SO4溶液中,下列粒子浓度关系正确的是( )
A.c(Na+)+c(H+)=c(OH-)+c(HSO-4)+2c( )
)
B.2c (Na+)=c( )+c(HSO-4)
)+c(HSO-4)
C.c(Na+)>c( )>c (H+)>c (OH-)
)>c (H+)>c (OH-)
D.c( )+c(HSO-4)="0.1" mol·L-1
)+c(HSO-4)="0.1" mol·L-1
(1)碱性 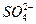 +H2O
+H2O
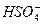 +OH-
+OH-
(2)小于 H2SO4一级电离出H+,对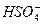 电离起抑制作用,而NaHSO4中不存在抑制作用
电离起抑制作用,而NaHSO4中不存在抑制作用
(3)AD
本题以新型信息为前提,考查盐类水解的判断,外界因素对电离平衡的影响以及溶液离子浓度大小关系。由于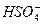 的电离是可逆的,所以
的电离是可逆的,所以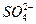 可以发生水解,Na2SO4溶液显碱性。溶液中存在的平衡体系有
可以发生水解,Na2SO4溶液显碱性。溶液中存在的平衡体系有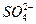 +H2O
+H2O
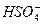 +OH-,H2O
+OH-,H2O H++OH-,溶液中各种离子浓度大小关系为:c(Na+)>c(
H++OH-,溶液中各种离子浓度大小关系为:c(Na+)>c(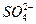 )>c (OH-)>c (
)>c (OH-)>c (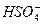 )>c(H+)。电荷守恒关系式:c(Na+)+c(H+)=c(OH-)+c(
)>c(H+)。电荷守恒关系式:c(Na+)+c(H+)=c(OH-)+c(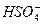 )+2c(
)+2c(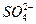 )。物料守恒关系式:c(
)。物料守恒关系式:c(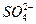 )+c(
)+c(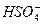 )="0.1" mol·L-1或c(Na+)=2c(
)="0.1" mol·L-1或c(Na+)=2c(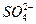 )+2c(
)+2c(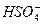 )。
)。
