问题
选择题
对0.2mol·L-1碳酸钠溶液的微粒浓度分析正确的是
A.[Na+]>[CO32-]>[OH-]>[HCO3-]>[H+]
B.[Na+]+[H+]=[CO32-]+[HCO3-]+[OH-]
C.[OH-]=[H+]+[HCO3-]+[H2CO3]
D.[CO32-]+[HCO3-]+[H2CO3]=0.2mol·L-1
答案
A、D
碳酸钠为强减弱酸盐,其溶液发生如下电离和水解过程:
Na2CO3====2Na++CO32-
CO32-+H2O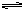 HCO3-+OH-
HCO3-+OH-
HCO3-+H2O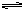 H2CO3+OH-
H2CO3+OH-
故溶液中存在的微粒有Na+、H+、OH-、CO32-、HCO3-、H2CO3等,它们的浓度关系:[Na+]>[CO32-]>[OH-]>[HCO3-]>[H+]。按电荷守恒分析其浓度关系:
[Na+]+[H+]=[HCO3-]+2[CO32-]+[OH-]
按物料守恒分析其浓度关系:
[Na+]=[CO32-]+[HCO3-]+[H2CO3]
∵[Na+]=0.2mol·L-1, ∴[CO32-]+[HCO3-]+[H2CO3]=0.2mol·L-1。
