问题
计算题
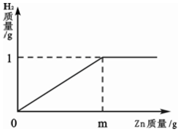
已知烧杯中装有200g硫酸和硫酸锌混合溶液,其中含硫酸锌12.1g.向烧杯中逐渐加入锌粒,放出气体质量与加入锌粒质量的关系如图所示.当恰好完全反应时,所得的溶液为不饱和溶液.请计算:
(1)m=_________(2)原混合溶液中H2SO4的质量分数为_________.
答案
(1) 32.5 (2)24.5%
题目分析:(1)据右上图可知,最终生成的氢气质量是1g,根据发生的化学反应方程式:H2SO4 +Zn =ZnSO4 + H2↑中锌与氢气的质量关系,即可算出消耗的锌的质量,同理,根据H2SO4和氢气的质量关系,也可算出硫酸的质量,再利用质量分数的表达式即可求解:
解:设参加反应锌的质量为m,消耗H2SO4的质量为x
H2SO4 +Zn = ZnSO4 + H2↑
98 65 2
X m 1g
65:2=m:1g ∴m=32.5g
98:2=x:1g ∴x=49g 原混合溶液中H2SO4的质量分数为=49g/200g×100%=24.5%
