(1)在饱和氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同时还产生的现象有
①____________________________________________________________________________;
②____________________________________________________________________________。
用离子方程式表示产生上述现象的原因___________________________________________
____________________________________________________________________________。
(2)在饱和氯化铁溶液中加入一种单质,也会产生类似上述现象的反应,这种单质是________。
A.磷
B.硫
C.镁
D.铜(3)向物质的量之和为0.1mol的FeCl3、AlCl3的混合溶液中加入90mL4mol·L-1的NaOH溶液,使其充分反应。假设原溶液中Al3+物质的量与Fe3+和Al3+总物质的量之比为x。
①当x=0.4时,溶液中产生的沉淀是_____________,其物质的量为_____________。
②当沉淀只有Fe(OH)3时,x的取值范围为_____________。
①有无色无味气体生成②溶液颜色变深,产生红褐色沉淀Fe3++3H2O Fe(OH)3+3H+CaCO3+2H+====Ca2++CO2↑+H2O(2)C(3)①Fe(OH)30.06mol②0<x≤0.6
Fe(OH)3+3H+CaCO3+2H+====Ca2++CO2↑+H2O(2)C(3)①Fe(OH)30.06mol②0<x≤0.6
(1)Fe3++3H2O Fe(OH)3+3H+2H++CaCO3====Ca2++H2O+CO2↑所以,平衡向右移动,溶液颜色加深,产生红褐色沉淀,同时生成CO2。
Fe(OH)3+3H+2H++CaCO3====Ca2++H2O+CO2↑所以,平衡向右移动,溶液颜色加深,产生红褐色沉淀,同时生成CO2。
(2)Mg能与H+反应
(3)①x=0.4,则n(AlCl3)=0.04mol,n(FeCl3)=0.06mol,n(NaOH)=4mol·L-1×0.09L=0.36mol
n[Fe(OH)3]=0.06mol,Fe3+消耗NaOH:0.06mol×3=0.18mol
n(NaOH)余∶n(AlCl3)=(0.36-0.18)mol∶0.04mol=9∶2
所以Al3+全部转化为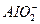 ,无沉淀。
,无沉淀。
②n(AlCl3)=0.1xmoln(FeCl3)=0.1(1-x)mol,沉淀只有Fe(OH)3,即Al3+全部转变为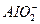 ,根据电荷守恒得:
,根据电荷守恒得:
0.1x+3×0.1x+3×0.1(1-x)≤0.36,即x≤0.6
所以0<x≤0.6。
