问题
计算题
将6.8 g含杂质的锌粒,加入到盛有50.0 g过量的稀硫酸的烧杯中(杂质不溶于水,也不与稀硫酸反应),充分反应后,称得烧杯内物质的总质量为56.6 g。试计算:
(1)生成氢气的质量。
(2)锌粒中所含锌的质量分数(精确到0.1%)。
答案
(1)0.2g; (2)95.6%
题目分析:解、(1)根据质量守恒定律知,生成的氢气的质量为:50.0g+6.8g-56.6g=0.2g
设、生成0.2g氢气需要金属锌的质量为X
Zn + H2SO4 = ZnSO4 + H2↑
65 2
X 0.2g
65:2=X:0.2g
X=6.5g
锌粒中所含锌的质量分数: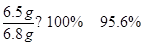
答:生成的氢气的质量为:0.2g;锌粒中所含锌的质量分数95.6%
