(2013山东济南)在工业上用纯碱和石灰石为原料制备烧碱,主要流程如图所示:

(1)在①﹣④四个过程中,发生了分解反应的是 (填序号)。
(2)检验烧碱溶液中含有少量Na2CO3的具体方法是 。
(3)在室温下,将53g质量分数为10%的Na2CO3溶液与3000g澄清石灰水充分混合,恰好完全反应.则这时所得NaOH溶液的质量是多少?(计算结果精确至0.1g)
(1)① (2)取适量溶液于试管中,滴加稀盐酸,若有气泡产生,则说明含有碳酸钠 (3) 3048.Og
题目分析:(1)碳酸钙在高温下生成氧化钙和二氧化碳,属于分解反应;氧化钙和水反应生成氢氧化钙,属于化合反应:氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,属于复分解反应;故填:①,
(2)因Na2CO3能与稀盐酸反应产生二氧化碳气体,在溶液中有气泡冒出,现象明显,可选稀盐酸,具体操作为:取适量溶液于试管中,滴加稀盐酸,若有气泡产生,则说明含有碳酸钠;故答案为:取适量溶液于试管中,滴加稀盐酸,若有气泡产生,则说明含有碳酸钠;
(3)解:设生成碳酸钙的质量为y,则
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
106 100
53g×10% y
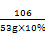 =
= 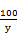
解得y=5g
所以NaOH溶液的质量为:53g+3000g﹣5g=3048.0g
