有一矿山上的石灰石样品中只含杂质二氧化硅(二氧化硅是一种既不溶于水,也不与盐酸反应的固体)。小琳和她的同学想测定该样品中碳酸钙的质量分数。他们取一块石灰石样品,将其粉碎后,称出9.4g放入烧杯内(烧杯的质量为60.8g),然后慢慢加入稀盐酸,用玻璃棒搅拌至不再产生气泡为止,共用去稀盐酸97.8g。再称出反应后烧杯及其内物质的总质量为164.7g。试回答:
(1)将石灰石样品粉碎的主要目的是 。
(2)实验结束后,共放出二氧化碳 g(假设溶解在水中的二氧化碳质量忽略不计)。
(3)该石灰石样品中碳酸钙的质量分数是多少?(计算结果精确到0.1%)
(4)反应后溶液的质量为 g。
(1)为了增大反应物的接触面积,使反应能快速进行
(2)3.3g
(3)79.8%
(4)102
题目分析:(1)为避免样品中碳酸钙不能完成反应,可把样品粉碎,增大样品与盐酸的接触面积,此举还可以加快反应的速率;
(2)根据质量守恒定律可以知道放出气体二氧化碳的质量=9.4g+60.8g+97.8g-164.7g=3.3g
(3)设石灰石样品中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 2.2g
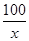 =
= 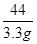
解得:x=7.5g
该石灰石中w(CaCO3)= 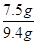 ×100%=79.8%
×100%=79.8%
答:该石灰石样品中碳酸钙的质量分数是79.8%.
(4)反应后溶液的质量为:164.7g-60.8g-(9.4g-7.5g)=102g
