问题
选择题
25 ℃时,某NH4Cl溶液的pH为4,下列说法中不正确的是( )
A.溶液中c(H+)>c(OH-)且c(H+)·c(OH-)=1×10-14
B.由水电离出来的c(H+)约为1×10-14 mol·L-1
C.溶液中c(Cl-)>c(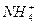 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.此溶液中水的电离度比纯水的电离度大
答案
答案:B
本题主要考查发生水解反应的盐溶液中水的电离平衡的移动及溶液中离子浓度大小的比较。在NH4Cl溶液中因: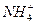 +H2O
+H2O NH3·H2O+H+而显酸性,常温下,稀溶液的KW保持不变,A正确;该溶液中c(H+)=1×10-4 mol·L-1,全部由水电离得到,故B不正确;NH4Cl溶液中
NH3·H2O+H+而显酸性,常温下,稀溶液的KW保持不变,A正确;该溶液中c(H+)=1×10-4 mol·L-1,全部由水电离得到,故B不正确;NH4Cl溶液中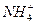 水解,c(H+)>c(OH-),但
水解,c(H+)>c(OH-),但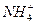 水解程度不大,往水中加入能水解的盐,将使水的电离平衡向正反应方向移动,使水的电离程度增大,C、D正确。
水解程度不大,往水中加入能水解的盐,将使水的电离平衡向正反应方向移动,使水的电离程度增大,C、D正确。
