进行如图所示的化学实验(装置气密性良好),通过二氧化碳中碳元素与氧元素的质量比来证明二氧化碳的组成,探究过程如下:
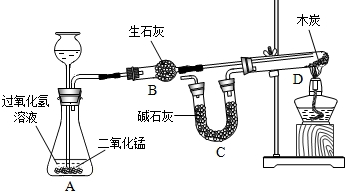
Ⅰ.称量有干燥块状木炭的试管D,质量为a g,装有碱石灰的C装置质量为b g,连接A、B、D装置;
Ⅱ.从长颈漏斗中加入3%的过氧化氢溶液,连接C装置,点燃酒精灯;
Ⅲ.待D中发生反应,熄灭酒精灯,冷却;
Ⅳ.称量试管D及剩余固体质量为cg,装置C的质量为dg;
已知:碱石灰用于吸收二氧化碳,木炭中的杂质不参加反应,B、C中所装药品能完全吸收相关物质.请回答下列问题:
①二氧化锰的作用是 ,装置B的作用是 ,B中发生反应的化学方程式为 ;
②为减少误差,步骤Ⅲ冷却过程中需要注意的问题是 ;
③除②中注意的问题外,该实验过程中还存在一定的误差,你认为产生误差的原因是 ;
④这个实验中如果生成的氧气的质量为16克,则需要参加反应的过氧化氢的物质的量为多少摩尔?(根据化学方程式计算,写出计算过程)
①催化 吸水干燥 CaO+H2O=Ca(OH)2;
②要将产生的二氧化碳的全部排出;
③空气中的二氧化碳能进入C装置(或反应过程中产生一氧化碳,合理即可);
④1mol
题目分析:①二氧化锰在过氧化氢分解反应中的作用是催化作用,装置B中生石灰的作用是吸水干燥氧气,化学方程式为:CaO+H2O=Ca(OH)2;
②为减少误差,步骤Ⅲ冷却过程中需要注意的问题是:要将产生的二氧化碳的全部排出;
③除②中注意的问题外,该实验过程中还存在一定的误差,你认为产生误差的原因是:空气中的二氧化碳能进入C装置;使实验结果偏大;
④设参加反应的过氧化氢的物质的量为x,
2H2O2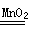 2H2O+O2↑
2H2O+O2↑
2mol 32g
x 16g
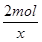 =
=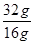
x=1mol
