(3分)为了测定某产品中碳酸钡的质量分数进行了如下实验。取一定量的样品和400g溶质质量分数为10%的稀盐酸放入烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录如下表:(假设反应匀速进行;杂质不溶于水,也不与稀盐酸反应,烧杯的质量为25.4g)
| 反应时间 | t1 | t2 | t3 | t4 | t5 |
| 烧杯和药品质量/g | 516.6 | 507.8 | m | 503.4 | 503.4 |
请计算:(反应方程式为:BaCO3 + 2HCl = BaCl2 + H2O + CO2↑)
(1)表中的“m”为。
(2)该产品中碳酸钡的质量分数。
(3)当产品中碳酸钡与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数。
(1)503.4g(2)98.5%;(3)23.6%
题目分析:(1)由题中的叙述反应为匀速进行,故每个时间段减少的质量应该相等,t1到t2减少的质量为516.6-507.8= 8.8g,到t4时也没在减少8.8g,故在t3反应段碳酸钡就反应完,故剩余质量为503.4g
(2)生成的二氧化碳的总质量为:516.6g-507.8g=8.8g, 507.8g-503.4g=4.4g, 8.8g+8.8g+4.4g=22g
解:设碳酸钡的质量为x,消耗盐酸的质量为y,产生氯化钡的质量为z。
BaCO3 + 2HCl = BaCl2 + H2O + CO2↑
197 73 208 44
x y z 22g
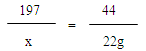
X=98.5g
503.4g+22g-25.4g-400g=100g
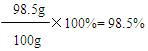
答:该产品中碳酸钡的质量分数为98.5%。
(3)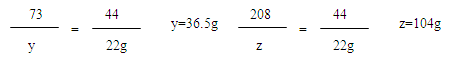
36.5g÷10%=365g
365g+98.5g-22g=441.5g
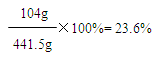
答:若产品中碳酸钡与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数为23.6%。
