问题
计算题
小玉同学在实验室发现了一瓶敞口放置的过氧化氢溶液,他认为该溶液中溶质的质量分数减小了,需要重新测定并更换试剂瓶的标签。他做了如下实验:称量该溶液34.0g倒入烧杯中,然后向其中加入少量二氧化锰,直到不再放出气体后,再称量烧杯中混合物的质量,称量结果为33.7g。
(1)该溶液溶质的质量分数减小的理由是__________________________。
(2)若二氧化锰的质量是0.5g,则生成的气体的质量为___________g。
(3)计算该瓶溶液中溶质的质量分数。
答案
①溶液中过氧化氢在常温下能缓慢分解成水和氧气。
②0.8 ③5%
题目分析:依据质量守恒定律化学反应前后物质的总质量不变,那么减少的质量为生成的氧气的质量;再利用化学方程式,根据氧气的质量可求出过氧化氢的质量;
氧气的质量= 34g+0.5g-33.7g=0.8g
解:设产生0.8g氧气需要过氧化氢的质量为x
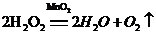
68 32
x 0.8g
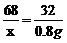
x=1.7g
此过氧化氢溶液中溶质的质量分数为 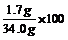 %=5%
%=5%
答:该瓶溶液中溶质的质量分数为5%。