某溶液中可能含有下 * * 种离子中的某几种:Na+、NH4+、Mg2+、Al3+、Clˉ。为确认该溶液组成进行如下实验:①取20.0 mL该溶液,加入25.0 mL 4.00 mol·L-1NaOH溶液,有白色沉淀、无剌激气味气体。过滤、洗涤、干燥,得沉淀1.16 g。再将滤液稀释至100 mL,测得滤液中c(OHˉ)为0.20 mol·L-1;②另取20.0 mL该溶液,加入足量的AgNO3溶液,生成白色沉淀11.48 g。由此可得出关于原溶液组成的正确结论是
A.一定含有Mg2+、Al3+、Clˉ,不含Na+、NH4+
B.一定含有Na+、Mg2+、Clˉ,不含NH4+,可能含有Al3+
C.c (Clˉ) 为 4.00 mol·L-1,c (Al3+) 为1.00 mol·L-1
D.c (Mg2+) 为 1.00 mol·L-1,c(Na+ ) 为 0.50 mol·L-1
答案:D
题目分析:根据实验①判断,原溶液中一定有Mg2+,无NH4+。参加反应的OHˉ: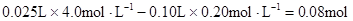 ,n(Mg2+)=
,n(Mg2+)= Mg2+ + 2OHˉ= Mg(OH)2↓,与Mg2+反应的OHˉ:
Mg2+ + 2OHˉ= Mg(OH)2↓,与Mg2+反应的OHˉ: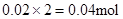 ,所以原溶液中一定存在Al3+。与Al3+反应的OHˉ:
,所以原溶液中一定存在Al3+。与Al3+反应的OHˉ: ,因滤液中还余OHˉ,则发生反应 Al3+ + 4OHˉ= AlO2ˉ + 2H2O ,n(Al3+ )=
,因滤液中还余OHˉ,则发生反应 Al3+ + 4OHˉ= AlO2ˉ + 2H2O ,n(Al3+ )= 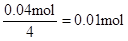 ;由实验②结合上面的计算数据,得 n(Clˉ)=
;由实验②结合上面的计算数据,得 n(Clˉ)= 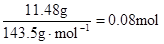 ; n(Clˉ)>2n(Mg2+) + 3n(Al3+ ) 所以原溶液中还含有 Na+ ;2n(Mg2+) + 3n(Al3+ )+ n(Na+ ) =
; n(Clˉ)>2n(Mg2+) + 3n(Al3+ ) 所以原溶液中还含有 Na+ ;2n(Mg2+) + 3n(Al3+ )+ n(Na+ ) =  n(Na+ ) =
n(Na+ ) = 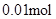
原溶液中离子的浓度:
c (Clˉ) =  c (Al3+)=
c (Al3+)=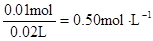
c (Mg2+)= c(Na+ )=
c(Na+ )= 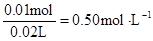
故选D。
