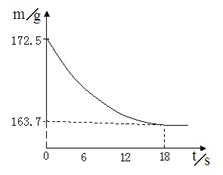
某公司生产出的纯碱产品中经检测只含有氯化钠杂质。为测定产品中碳酸钠的质量分数,20℃时,称取该产品样品26.5g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如下图所示。
求:(1)生成CO2的质量。
(2)反应后所得溶液中NaCl的质量分数。
(1)8.8g;(2)16.9%
题目分析:(1)生成二氧化碳的质量为172.5g-163.7 g = 8.8 g
(2)设:样品中碳酸钠的质量为x ,其与盐酸反应后生成NaCl质量为y。
Na2CO3 + 2HCl=2NaCl + CO2↑ + H2O
106 117 44
x y 8.8g
106:44=x:8.8g 117:44= y:8.8g
x=106×8.8g/44= 21.2g
y=117×8.8g/44= 23.4g
则反应后所得溶液中NaCl的质量分数为
23.4g+(26.5g-21.2g)/163.7g×100%=16.9%
答:(1)生成二氧化碳的质量8.8g。
(2)反应后所得溶液中NaCl的质量分数为16.9%。