下列叙述正确的是( )
A.在0.1 mol·L-1 CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
B.把0.1 mol·L-1氨水和0.1 mol·L-1 HCl溶液充分反应后混合溶液pH="7"
C.在0.1 mol·L-1 NaHS溶液中,c(Na+)=2c(S2-)+c(HS-)+c(H2S)
D.在0.1 mol·L-1的小苏打溶液中,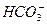 的电离程度大于
的电离程度大于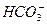 的水解程度
的水解程度
答案:A
在0.1 mol·L-1 CH3COONa溶液中发生CH3COO-+H2O CH3COOH+OH-和H2O
CH3COOH+OH-和H2O H++OH-,所以c(OH-)=c(CH3COOH)+c(H+);0.1 mol·L-1氨水和0.1 mol·L-1 HCl溶液,不知道溶液体积为多少,所以无法确定pH;C项在0.1 mol·L-1 NaHS溶液中存在物料守恒:c(Na+)=c(S2-)+c(HS-)+c(H2S);D项小苏打溶液显碱性,
H++OH-,所以c(OH-)=c(CH3COOH)+c(H+);0.1 mol·L-1氨水和0.1 mol·L-1 HCl溶液,不知道溶液体积为多少,所以无法确定pH;C项在0.1 mol·L-1 NaHS溶液中存在物料守恒:c(Na+)=c(S2-)+c(HS-)+c(H2S);D项小苏打溶液显碱性,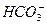 的水解程度大于
的水解程度大于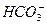 的电离程度。
的电离程度。
