问题
计算题
(3分)某化学兴趣小组的同学对一份固体样品进行了探究。通过实验已确定该样品由氧化铁和铁粉混合而成。他们称取了13.6g固体样品,用图1所示的装置继续实验,测定的部分数据如图2所示。
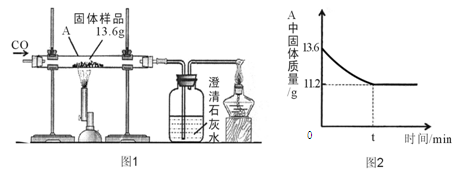
请计算:固体样品中氧化铁的质量是多少?
答案
氧化铁中氧元素的质量为:13.6 g -11.2 g =2.4 g
固体样品中氧化铁的质量为:2.4 g÷(48/160)="8g"
答: 略
题目分析:高温条件下,氧化铁能和一氧化碳反应生成铁和二氧化碳,完全反应后,A中的固体全部是铁,质量减少的是氧元素的质量;根据氧元素的质量可以计算氧化铁的质量。设氧化铁的质量为x,
氧化铁的化学式是Fe2O3,减少的氧元素的质量为:13.6g-11.2g=2.4g,
所以有x×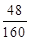 ×100%=2.4g, x=8g;
×100%=2.4g, x=8g;
答:固体样品中氧化铁的质量为8g.
