常温下有浓度均为0.5 mol·L-1的四种溶液:①碳酸钠溶液②碳酸氢钠溶液③盐酸④氨水。请根据题目要求回答下列问题:
(1)上述溶液中,可发生水解反应的是___________(填序号,下同),在发生水解反应的溶液中pH最大的是____________________。
(2)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是____________________。
(3)取适量溶液④,加入少量氯化铵固体,此时溶液中 的值_________(填“增大”“减小”或“不变”)。
的值_________(填“增大”“减小”或“不变”)。
(4)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是___________。
(5)取10 mL溶液③,加水稀释到500 mL,则该溶液中由水电离出的c(H+)=______________。
(1)①② ① (2)② (3)减小
(4)c(Cl-)]>c(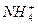 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
(5)10-12 mol·L-1
(2)既能与氢氧化钠溶液反应,又能与硫酸溶液反应的物质有弱酸的酸式盐、弱酸的铵盐、铝、氢氧化铝、氧化铝等。(3)加入少量氯化铵固体,使NH3·H2O
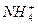 +OH-向逆反应方向移动,c(OH-)减小,c(NH3·H2O)增大。(4)恰好反应生成NH4Cl溶液,水解显酸性。(5)加水稀释到500 mL,溶液浓度为0.01 mol·L-1,溶液中的c(H+)=10-2 mol·L-1,溶液中的c(OH-)=10-12 mol·L-1,溶液中的OH-就等于水电离出的OH-,即该溶液中由水电离出的c(H+)=c(OH-)=10-12 mol·L-1。
+OH-向逆反应方向移动,c(OH-)减小,c(NH3·H2O)增大。(4)恰好反应生成NH4Cl溶液,水解显酸性。(5)加水稀释到500 mL,溶液浓度为0.01 mol·L-1,溶液中的c(H+)=10-2 mol·L-1,溶液中的c(OH-)=10-12 mol·L-1,溶液中的OH-就等于水电离出的OH-,即该溶液中由水电离出的c(H+)=c(OH-)=10-12 mol·L-1。
