小明在老师的指导下粗略测量一瓶稀盐酸的溶质质量分数,具体步骤如下:
步骤一:配制溶质质量分数约为1%的氢氧化钠溶液。
步骤二:向10克待测稀盐酸中逐滴滴入上述氢氧化钠溶液,并使
用pH计记录溶液的pH变化情况,绘制图像如图。
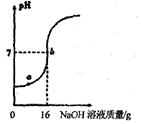
(1)在“步骤一”中有计算、 、溶解三个具体步骤。
(2)在往稀盐酸中逐渐滴入氢氧化钠溶液的过程中,在a点的溶液中
的微粒有 。(用化学符号表示)
(3)请结合右图,计算①该稀盐酸的溶质质量分数;②b点时溶液中溶质的质量分数。(结果精确到0.1%)(写出计算过程)
(1)称量(2)Na+、H+、Cl-、H2O;(3)1.46%;0.9%
题目分析:配制溶液的步骤为:计算、称量、溶解;氢氧化钠与盐酸发生的是中和反应,由图可知,当加入氢氧化钠溶液的质量为16g时,氢氧化钠与盐酸恰好完全反应,溶液的PH=7,在a点时,溶液的PH<7,溶液呈酸性,即盐酸过量,那么此时溶液中的溶质有盐酸和生成的氯化钠,存在的微粒是:Na+、H+、Cl-、H2O;利用化学方程式,根据氢氧化钠溶液中溶质的质量及与盐酸反应的质量比可求出参加反应的盐酸的溶质质量;b点时氢氧化钠与盐酸恰好完全反应,溶质是氯化钠,利用化学方程式可求出。
(3)解,设参加反应的盐酸的溶质质量为x,生成的氯化钠的质量为y;
16g氢氧化钠溶液中溶质的质量=16g×1%=0.16g
HCl+ NaOH="=" NaCl+H2O
36.5 40 58.5
x 0.16g y
36.5/40=x/0.16g 58.5/40=y/0.16g
x=0.146g y=0.234g
稀盐酸的溶质质量分数=0.146g/10g ×100%=1.46%
反应后溶液的质量=10g+16g=26g
恰好反应时氯化钠的质量分数=0.234g/26g ×100%=0.9%
答:略
