问题
计算题
某长期暴露在空气中的烧碱样品已部分变质,为了测定其纯度,现进行如下实验:取样品18.6g加入到85.8g水中充分搅拌至完全溶解,向所得溶液中逐滴滴加稀盐酸,产生气体的质量与所加稀盐酸质量的关系如图所示。分析题意并回答下列问题:
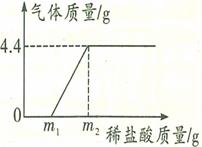
(1)反应过程中生成气体的质量是 。
(2)该烧碱样品中氢氧化钠的质量是多少克(写出规范的解题过程)?
(3)所用稀盐酸的溶质质量分数是 (用ml和m2表示)。
答案
(1)4.4g (2)8.0g (3)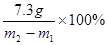
题目分析:解(1)由题中图示及质量守恒定律可知反应过程中生成气体的质量为4.4g
(2)设样品中碳酸钠的质量为X,盐酸中氯化氢的质量为Y
Na2CO3+2HCl==2NaCl+H2O+CO2↑
73 44
X y 4.4g
106:44=X:4.4g 73:44=y:4.4g
X=10.6g y=7.3g
故样品中氢氧化钠的质量为:18.6g-10.6g=8g
(3)所用稀盐酸的溶质质量分数是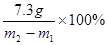
答;反应过程中生成气体的质量为4.4g, 样品中碳酸钠的质量为8g, 所用稀盐酸的溶质质量分数是