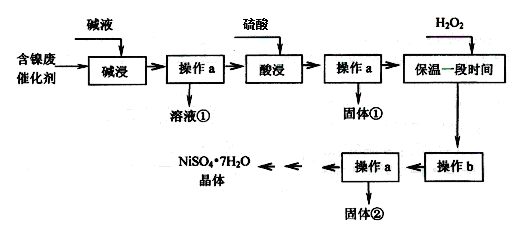
某化工厂的含镍废催化剂主要含Ni,还含有Al、Al2O3、Fe、FeO、Fe2O3及其他不溶杂质(其他不溶杂质不与酸碱反应)。某校化学研究性学习小组设计了如下图所示的方法,以该含镍废催化剂为原料来制备NiSO4·7H2O。
【查阅资料】
①Ni能与非氧化性酸反应生成Ni2+,不与碱液反应。
②部分阳离子以氢氧化物形式沉淀时pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 4.1 | 1.7 | 7.6 | 7.0 |
| 完全沉淀的pH | 5.2 | 3.2 | 9.5 | 9.2 |
(1)操作a为 。
(2)“碱浸”的目的是除去 (填化学式)。
(3)操作b为调节溶液的pH,你认为pH的最佳调控范围是 。
(4)NiSO4在强碱溶液中用次氯酸钠氧化,可以制得碱性镍氢电池电极材料NiOOH。
①写出该反应的离子方程式 。
②已知碱性镍氢电池总反应: H2+2NiOOH 2Ni(OH)2,写出该反应放电时正极反应式 。
2Ni(OH)2,写出该反应放电时正极反应式 。
(5)一般认为残留在溶液中的离子浓度小于1.0×10-5 mol·L-1时,沉淀已经完全。请利用上表中数据估算Fe(OH)2的溶度积 。
。
(1)过滤 (2分) (2)Al、Al2O3(2分) (3)3.2≤pH<7.0 (2分)
(4)①2Ni2++ClO-+4OH-=2NiOOH+Cl-+H2O(3分) ②NiOOH + H2O + e- = Ni(OH)2 + OH- (3分)
(5)1.0×10-14 mol3·L-3(2分)
题目分析:(1)捏Ni、Fe、FeO、Fe2O3及其他不溶杂质均不与碱反应,所以碱液浸后金属铝、氧化铝溶解,其它物质不溶,过滤即可除去,所以操作a是过滤。
(2)“碱浸”的目的是除去含镍废催化剂Al、Al2O3。
(3)由于前面加入了氧化剂双氧水,所以溶液中的亚铁离子被氧化生成了铁离子。根据表中数据可知,铁离子完全沉淀时的pH值是3.2,而Ni2+开始沉淀时的pH值是7.0,因此操作b应该控制溶液的pH值为3.2≤pH<7.0。
(4)①NiSO4在强碱溶液中用次氯酸钠氧化,可以制得碱性镍氢电池电极材料NiOOH,在反应中氯元素的化合价从+1价降低到-1价,得到2个电子。而Ni元素的化合价从+2价升高到+3价失去1个电子,所以还原剂硫酸镍与氧化剂次氯酸钠的物质的量之比是2:1,因此反应的离子方程式为2Ni2++ClO-+4OH-=2NiOOH+Cl-+H2O。
②原电池中负极失去电子,发生氧化反应。电子经导线传递到正极,所以正极得到电子,发生还原反应。根据方程式可知放电时氢气是还原剂失去电子,NiOOH是氧化剂得到电子,做正极,因此正极电极反应式为NiOOH + H2O + e- = Ni(OH)2 + OH-。
③根据表中数据可知,氢氧化亚铁完全沉淀时的pH值是9.5,根据氢氧化亚铁的溶度积常数表达式Ksp=c(Fe2+)·c2(OH-),氢氧化亚铁的溶度积常数Ksp=1.0×10-5 mol·L-1×(10-4.5mol/L)2=1.0×10-14 mol3·L-3。
