问题
计算题
(3分)电动自行车、小汽车等交通工具中都有为其提供电能的铅蓄电池(又称“电瓶”),它的优点是可以充电循环使用,电瓶内发生的化学反应是:
PbO2(固)+ 2H2SO4 + Pb = 2PbSO4↓+ 2H2O
某电瓶中装有36%的稀硫酸1200 g,电瓶工作时有310.5 g的铅参加反应。试计算:
(1)原稀硫酸中所含溶质的质量是 g。
(2)电瓶工作时消耗硫酸的质量。
(3)反应后硫酸溶液中溶质的质量分数。(最后结果精确到0.01%)
答案
(1)432g ; (2)294g ;(3)14.36g
题目分析:(1)原来m(溶质)=1200g×36%=432 g…………………………………………………(1分)
(2)解:设需消耗纯稀硫的质量为x,同时生成水的质量为y。
PbO2 (固)+ 2H2SO4 + Pb = 2PbSO4 ↓+ 2H2O
196 207 36
x 310.5g y
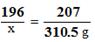
x =294g …………………………………………………(1分)
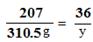
y=54g
剩余m(溶质)=432g-294g=138g
剩余m(溶液)=1200g-294g+54g=960g
(3)剩余H2SO4 溶液中溶质的质量分数=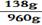 x 100% =14.38% ……(1分)
x 100% =14.38% ……(1分)
答:需消耗稀硫酸中溶质为294g,此时电瓶中硫酸溶液中溶质的质量分数是14.38%。
考点:根据化学方程式的计算、有关溶液的计算
