问题
计算题
中和反应是放热反应。取10 ml溶质质量分数为10%的NaOH溶液(密度1.10g/ml)置于烧杯中(并滴入2滴酚酞),向烧杯中逐滴加入稀盐酸。随着盐酸的滴入,烧杯中溶液颜色从红色逐渐变浅,当加入10 ml稀盐酸时,溶液恰好变为无色。烧杯中溶液温度与加入盐酸体积之间关系如图所示。
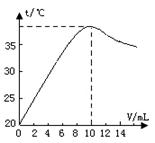
(1)当加入4ml稀盐酸时,烧杯中溶液的溶质为
(写化学式)
(2)试解释烧杯中溶液温度随加入盐酸的体积发生变化的
原因 。
(3)当盐酸与氢氧化钠恰好中和时生成氯化钠多少克?
(精确到0.1g)
答案
(1)NaOH NaCl
(2)中和反应放热,随着反应的进行,放出热量增加,溶液温度逐渐升高,加入10毫升稀盐酸时恰好完全反应,溶液温度最高。继续加入盐酸后,溶液被稀释冷却,温度逐渐下降。
(3)1.6g
题目分析:
(1)由图可知,当加入10毫升稀盐酸时恰好完全反应,故加入4ml稀盐酸时,氢氧化钠过量,此时烧杯中溶液的溶质为NaOH和NaCl;
(3)根据质量守恒定律利用氢氧化钠与氯化钠的质量比即可求出氯化钠的质量。
解:设生成氯化钠的质量为x
NaOH + HCl = NaCl + H2O
40 58.5
1.1mL×1.1g/mL×10% x
40/( 1.1mL×1.1g/mL×10%)=58.5/x
x=1.6g
答:略
