大气中硫、氮的氧化物是形成酸雨的主要物质。某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl-、SO32-、SO42-、NO3-等。某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成三份,进行如下实验:
| 试样 | 所加试剂 | 实验现象 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 溶液呈蓝色 |
| 第二份试液 | 滴加用盐酸酸化的BaCl2溶液 | 有白色沉淀产生 |
| 第三份试液 | 滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀、产生的气体的物质的量(n)的关系如右图 | 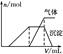 |
请回答下列问题:
(1)根据实验结果判断该酸雨中肯定不存在的离子是______________,不能确定的离子有________________。
(2)写出第一份试液滴加淀粉KI溶液时发生反应的离子方程式:__________________。
(3)第三份试液滴加NaOH溶液,加热,整个过程中发生了多个反应,写出其中两个反应的离子方程式:__________________________________、__________________________。
(4)设计实验方案,检验该酸雨中是否存在Cl-:___________________________________
______________________________。
(5)该小组为了探究NO参与硫酸型酸雨的形成过程,在烧瓶中充入含有少量NO的SO2气体,再慢慢通入O2,发生化学反应后,再喷洒适量蒸馏水即得硫酸型酸雨,则NO在上述反应中的作用是________________________________________________________。
(1)SO32-、Ba2+ Na+、Cl-
(2)6I-+2NO3-+8H+=2NO↑+3I2+4H2O
(3)H++OH-=H2O NH4++OH- NH3↑+H2O Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O(任写两个)
NH3↑+H2O Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O(任写两个)
(4)取少量试液滴加足量的Ba(NO3)2溶液,静置取上层澄清液,加HNO3酸化的AgNO3溶液,若有白色沉淀生成,则证明存在Cl-
(5)催化剂
(1)由第一份试液产生的现象知该酸雨中含有NO3-,因酸性条件下SO32-不能与NO3-共存,故试液中没有SO32-;由第二份试液产生的现象知该酸雨中含有SO42-,没有Ba2+;由第三份试液产生的现象知该酸雨中含有Al3+、NH4+。故该酸雨中肯定不存在的离子是SO32-、Ba2+,不能确定的离子有Na+、Cl-。(2)滴加淀粉KI溶液时,I-被氧化为I2、NO3-被还原为NO。(3)第三份试液中OH-分别与H+、Al3+、NH4+、Al(OH)3发生反应。(4)检验Cl-时,需要先用足量的Ba(NO3)2溶液将SO42-除去以排除干扰,然后用HNO3酸化的AgNO3溶液进行检验。(5)NO能被氧化成NO2,NO2遇水可转化为HNO3,稀HNO3氧化SO32-最终得到的是硫酸型酸雨,因此NO在酸雨形成过程中作催化剂。
