为了探究石灰石与稀盐酸反应制备二氧化碳后的废液中的溶质成分,将废液过滤,取滤液20克于烧杯中,在不断振荡的条件下,向其中滴加质量分数为10.6%的碳酸钠溶液直至过量,有关的变化如图所示:根据题中有关信息和图像分析回答下列问题:
原废液中的溶质成分有 用化学式回答)。
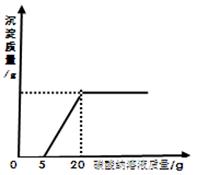
(2)A点处溶液中溶质的质量是多少克?(通过计算回答)
HCl和CaCl2 1.2g
题目分析:(1)石灰石与盐酸反应后的废液中一定含有溶质氯化钙,加入碳酸钠开始没有沉淀生成,说明废液中含有多余的盐酸,故含有的溶质有氯化钙和氯化氢;
(2)根据图象:开始时盐酸消耗的碳酸钠溶液的质量是5g,氯化钙消耗的碳酸钠溶液的质量是15g,然后据溶质的质量=溶液的质量×溶质的质量分数计算出相应的碳酸钠溶液中碳酸钠的质量,结合方程式计算出生成的氯化钠的质量,二氧化碳的质量、碳酸钙的质量,据溶质的质量分数解答即可。
A点处废液中的溶质恰好完全反应,盐酸消耗的碳酸钠溶液的质量是5g,碳酸钠溶液含有碳酸钠的质量是5g×10.6%=0.53g;
设碳酸钠溶液与盐酸反应生成氯化钠的质量为x,生成二氧化碳的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
0.53g x y
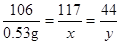 x=0.585g y=0.22g
x=0.585g y=0.22g
氯化钙消耗的碳酸钠溶液的质量是15g,碳酸钠溶液含有碳酸钠的质量是15g×10.6%=1.59g;
设碳酸钠溶液与氯化钙反应生成氯化钠的质量为a,生成碳酸钙的质量为b
Na2CO3+CaCl2=CaCO3↓+2NaCl,
106 100 117
1.59g a b
 a=1.5g b=1.755g
a=1.5g b=1.755g
A点处溶液的质量是:20g+20g﹣0.22g﹣1.5g=38.28g
所得溶液中氯化钠的质量分数为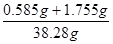 ×100%≈6.1%
×100%≈6.1%
