问题
计算题
(3分)在13 g锌粉中加入过量的20%的硫酸铜溶液,充分反应后过滤,得到242.2 g溶液,则反应后溶液中剩余的硫酸铜的质量是多少?
答案
16.4g
题目分析:根据反应:Zn + CuSO4 = ZnSO4 + Cu,可计算出参加反应的硫酸铜质量以及生成铜的质量,反应后溶液中剩余的硫酸铜的质量应等于原硫酸铜的总质量减去参加反应的硫酸铜质量
解:设13 g锌消耗的CuSO4质量为x,生成Cu的质量为y
Zn + CuSO4 = ZnSO4 + Cu
65 160 64
13 g 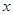 y
y
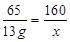
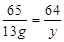
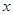 =" 32" g y =" 12.8" g
=" 32" g y =" 12.8" g
CuSO4溶液的质量为 242.2 g + 12.8 g - 13 g =" 242" g
∴ 剩余的CuSO4质量为 242 g×20% - 32 g =" 16.4" g
