问题
选择题
下列叙述中正确的是
A.体积相同、浓度均为0.1mol/L的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m<n
B.有甲、乙两醋酸溶液,测得甲的pH=a,乙的pH=a+1,若用于中和等物质的量浓度等体积的NaOH溶液,需甲、乙两酸的体积V(乙)>10V(甲)
C.25℃,pH=9的NaOH溶液和NaAc溶液中,由水电离出的c(H+)均为10-5mol·L-1
D.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)该式满足NaHCO3溶液中的离子浓度关系。
答案
BD
A:体积相同、浓度均为0.1mol/L的NaOH溶液、氨水,由于前者全部电离、后者部分电离,前者的pH大于后者,而在稀释过程,两者的pH均减小,但由于弱碱氨水中存在电离平衡,可补充部分OH—,导致氨水溶液的pH降低速率相对较小,故无法确定两溶液pH均为9时两者稀释的倍数大小
B:设甲、乙两醋酸溶液的电离度分别为α甲、α乙,由于前者酸性强,浓度较大,α甲相对较小;根据c(H+)=cα可知,c甲=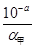 ,c乙=
,c乙=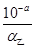 ;
;
依题意可知,两溶液所含有溶质的物质的量相等,即: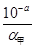 V甲=
V甲=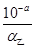 V乙,推得
V乙,推得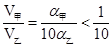 ,即V(乙)>10V(甲),正确
,即V(乙)>10V(甲),正确
C:NaOH溶液和NaAc溶液,前者OH—抑制了水的电离:H2O H++OH-,而后者弱离子水解促进水的电离,故两溶液中水电离出的c(H+)一定不相等,排除
H++OH-,而后者弱离子水解促进水的电离,故两溶液中水电离出的c(H+)一定不相等,排除
D:符合电荷守恒,正确
答案为BD
