问题
选择题
某化学研究性学习小组对电解质溶液作如下的归纳总结:(均在常温下)
①常温下,pH=1的强酸溶液,加水稀释后,溶液中各离子的浓度一定降低
②pH=2的盐酸与pH=1的盐酸,c(H+)之比为2∶1
③25 ℃时,AgCl固体在等体积、等物质的量浓度的NaCl、CaCl2溶液中的溶解程度不同
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42—)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw,则三者关系为:Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液pH是乙溶液pH的两倍,则甲乙两溶液等体积混合,混合液pH可能等于7
其归纳正确的是( )
A.全部
B.③⑤⑥
C.④⑤⑥
D.①②④
答案
答案:B
①中c(OH-)增大;②中之比为1∶10;③因为CaCl2溶液中的c(Cl-)大于NaCl溶液中的,依据AgCl(s) Ag+(aq)+Cl-(aq),可知AgCl在NaCl溶液中的溶解程度大,正确;④溶液呈中性时,一定含有NH4+,依据电荷守恒c(Na+)+c(NH4+)+c(H+)=2c(SO42—)+c(OH-)可知c(Na+)+c(NH4+)=2c(SO42—),错误;⑤依据CH3COOHCH3COO-+H+、Ka=
Ag+(aq)+Cl-(aq),可知AgCl在NaCl溶液中的溶解程度大,正确;④溶液呈中性时,一定含有NH4+,依据电荷守恒c(Na+)+c(NH4+)+c(H+)=2c(SO42—)+c(OH-)可知c(Na+)+c(NH4+)=2c(SO42—),错误;⑤依据CH3COOHCH3COO-+H+、Ka=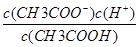 ;CH3COO-+H2OCH3COOH+OH-、Kh=
;CH3COO-+H2OCH3COOH+OH-、Kh=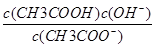 ,可知Ka·Kh=c(H+)·c(OH-),正确;⑥设乙溶液pH=a,甲溶液pH=2a,混合后溶液呈中性即10-a·V(酸)=102a-14·V(碱),所以-a=2a-14,此时a=14/3,正确。
,可知Ka·Kh=c(H+)·c(OH-),正确;⑥设乙溶液pH=a,甲溶液pH=2a,混合后溶液呈中性即10-a·V(酸)=102a-14·V(碱),所以-a=2a-14,此时a=14/3,正确。
