化合物A、B是中学常见的物质,其阴阳离子只能从下表中选择:
| 阳离子 | K+、Na+、Fe2+、Ba2+、NH4+、Ca2+ |
| 阴离子 | OH-、NO3—、I-、HCO3—、AlO2—、HSO4— |
(1)若A、B的水溶液均为无色,且A的水溶液呈强酸性,B的水溶液呈强碱性。混合后产生不溶于稀硝酸的白色沉淀及能使红色石蕊试纸变蓝的气体。
①B的化学式为________________。
②A、B溶液混合加热反应的离子方程式为________。
(2)若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色。向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化。则
①A的化学式为____________________。
②经分析上述过程中溶液变黄的原因可能有两种(用离子方程式表示):
i________________________________;ii_______________________________,
③请用一简易方法证明上述溶液变黄的原因:________。
④利用溶液变黄原理,将其设计成原电池,若电子由a流向b(a、b均为石墨电极),则b极的电极反应式为____________________。
(1)①Ba(OH)2
②H++SO42—+NH4++Ba2++2OH-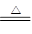 BaSO4↓+NH3↑+2H2O
BaSO4↓+NH3↑+2H2O
(2)①FeI2
②i.6I-+2NO3—+8H+=3I2+2NO↑+4H2O
ⅱ.2I-+Fe2++NO3—+4H+=I2+Fe3++NO↑+2H2O
(或3Fe2++NO3—+4H+=NO↑+2H2O+3Fe3+)
③取少量变黄溶液于试管中,滴加几滴KSCN溶液,若变红则Ⅱ合理
④NO3—+4H++3e-=NO↑+2H2O
(1)A的水溶液呈强酸性,知A中一定含有HSO4—,B的水溶液呈强碱性,知B中一定含有OH-,不溶于HNO3的白色沉淀是BaSO4,能使红色石蕊试纸变蓝的气体是氨气,所以A是NH4HSO4,B是Ba(OH)2。(2)①A的水溶液呈浅绿色说明一定含有Fe2+,B焰色反应为黄色说明含有Na+,而A的水溶液中含Fe2+且加入稀盐酸无明显现象说明一定不含有OH-、NO3—、HCO3—、AlO2—,但再加入B后变黄色说明B中含有NO3—(因为在酸性条件下NO3—具有氧化性),A、B溶液混合无明显现象说明A中不含HSO4—,所以A是FeI2。②Fe2+与I-在酸性条件下均可被NO3—氧化,且生成的Fe3+和I2的溶液均显黄色。③Fe3+可用KSCN溶液或苯酚鉴别,I2可用淀粉鉴别。④原电池中电子由负极流向正极,而b极作为原电池的正极得到电子发生还原反应,即NO3—被还原为NO。
点拨:本题考查无机物的性质及推断,考查考生推断和应用知识解决问题的能力。难度较大。
