问题
选择题
有关①100ml 0.1 mol/L  、②100ml 0.1 mol/L
、②100ml 0.1 mol/L  两溶液叙述不正确的是
两溶液叙述不正确的是
A.溶液中水电离出的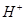 个数:②>①
个数:②>①
B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:
D.②溶液中:
答案
答案:C
选项A:因HCO3-的水解程度大于其电离程度,所以NaHCO3溶液显碱性;由于CO32-水解使得
Na2CO3溶液也显碱性。根据越弱越水解原理可知,HCO3-的水解程度小于CO32-,弱离
子水解程度越大,对水的电离程度,所以相同浓度的NaHCO3和Na2CO3溶液中,水电
离出的H+个数:②>①,所以A正确
选项B:HCO3-水解生成H2CO3和OH-,即消耗一个HCO3-的同时又生成一个OH-,水解的过程
中阴离子数不变;
但CO32-的第一级水解生成HCO3-和OH-,即消耗一个CO32-的同时却生成了两个阴离
子,水解的过程中,阴离子总数在增加;由于起始时CO32-和HCO3-的浓度相同,所以
溶液中阴离子的物质的量浓度之和:②>①,所以B正确
选项C:因HCO3-的水解程度大于其电离程度,所以①溶液中:c(H2CO3)>c(CO32-)
所以C错
选项D:CO32-的第一级水解生成HCO3-,第二级水解生成H2CO3,且以第一级水解为主,所以②
溶液中:c(HCO3-)>c(H2CO3),所以D正确
