(14分)依据题目要求回答下列问题。
(1)常温下,浓度均为0.lmol·L-1的下列六种溶液的pH如下表:

①上述盐溶液中的阴离子,结合H+能力最强的是
②根据表中数据,浓度均为0.0lmol·L-1的下 * * 种物质的溶液中,酸性最强的是 (填编号);将各溶液分别稀释100倍,pH变化最小的是 (填编号)

③据上表数据,请你判断下列反应不能成立的是 (填编号)


④要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为 。
(2)已知常温下 。又知常温下某CuSO4溶液里
。又知常温下某CuSO4溶液里
02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于____.
(3)已知可逆反应 是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:

①写出该反应平衡常数的表达式:____ 。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件:升高温度,混合气体的密度 (选填“增大”“减小”或“不变”);当 ,混合气体平均相对分子质量为 。
,混合气体平均相对分子质量为 。
(14分)(1)①CO32-(2分)②D;C (2分) ③D(2分)
④ Cl2+HCO3-="=" CO2+Cl-+HClO (分步书写参照给分)(2分)
(2) 5(2分)
(3)①c(CO2)/c(CO)(2分)②减小,33.3(2分)
(1)考察盐类水解应用。①根据“越弱越水解”知识点,不难得出CO32-离子水解程度是最大的。②同理可以比较得到五种酸的强弱大小顺序应该是:CH3COOH > H2CO3 > HClO > HCN > C6H5OH,稀释同样倍数条件下,酸性越小的酸变化越小。③D选项中不符合“强酸制弱酸”的原理。④氯水中生成的HCl和HClO,HCl会和HCO3-,而HClO不会和HCO3-,所有反应应该为Cl2+HCO3-="=" CO2+Cl-+HClO
(2)考察沉淀溶解平衡的应用。Ksp[Cu(OH)2]=c(Cu2+)·c(OH-)2,当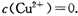 02 mol·L-1,c(OH-)=1×10-9 mol·L-1,则c(H+) =1×10-5mol·L-1,所有PH要大于5
02 mol·L-1,c(OH-)=1×10-9 mol·L-1,则c(H+) =1×10-5mol·L-1,所有PH要大于5
(3)考察平衡常数和平衡移动的因素。①该平衡中FeO和Fe为固体,浓度为一定值,故K= c(CO2)/c(CO);②由温度和平衡常数K关系表可知反应是放热反应,升高温度平衡逆方向移动,混合气体的密度减小;当 时,CO2占气体体积分数1/3,CO占气体体积分数2/3,所以混合气体平均相对分子质量为33.3
时,CO2占气体体积分数1/3,CO占气体体积分数2/3,所以混合气体平均相对分子质量为33.3
