(15分)I.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH4+) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH4+)。
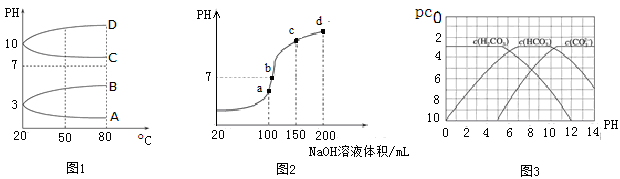
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母);
②20℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)= mol·L-1(填数值)。
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。
试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
II.pC是指极稀溶液中溶质物质的量浓度的常用对数负值, 类似pH。如某溶液溶质的浓度为1×10-3 mol·L-1,则该溶液中该溶质的pC=-lg10-3=3。已知H2CO3溶液中存在下列平衡:CO2+H2O H2CO3 H2CO3
H2CO3 H2CO3 H++HCO3- HCO3-
H++HCO3- HCO3- H++CO32-
H++CO32-
图3为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图。请回答下列问题:
(1)在pH=9时,H2CO3溶液中浓度最大的含碳元素的离子为 。
(2)pH<4时,溶液中H2CO3的pC总是约等于3的原因是 。
(3)已知M2CO3为难溶物,则其Ksp的表达式为 ;现欲将某溶液中的M+以碳酸盐(Ksp=)的形式沉淀完全,则最后溶液中的CO32-的pC最大值为 (溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀完全)。
Ⅰ、(1)小于(1分)
(2)①A (1分) ②10-3-10-11mol·L-1(2分,写成10-3 mol·L-1也给分)
(3)a(2分) c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)(2分)
II.(1)HCO3- (1分)
(2)c(H+)增大后,H2CO3 H++HCO3-平衡向左移动放出CO2,碳酸浓度保持不变;
H++HCO3-平衡向左移动放出CO2,碳酸浓度保持不变;
(3)Ksp=c2(M+)·c(CO32-)(2分) 2(2分)
题目分析:(1)相同条件下,因为 NH4++H2O NH3·HO+H+,酸能抑制NH4+的水解,0.1 mol·L-1 NH4Al(SO4)2中c(NH4+)小于0.1 mol·L-1NH4HSO4中c(NH4+)。
NH3·HO+H+,酸能抑制NH4+的水解,0.1 mol·L-1 NH4Al(SO4)2中c(NH4+)小于0.1 mol·L-1NH4HSO4中c(NH4+)。
(2)①因在水中NH4Al(SO4)2的水解,pH<7,升高温度,水解程度最大,pH减小,故变化的曲线是A;
②20℃时,0.1 mol·L-1NH4Al(SO4)2溶液pH=3,c(H+)=10-3mol·L-1,由电荷守恒可知:
2c(SO42-)+c(OH-)=c(NH4+)+3c(Al3+)+c(H+),2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+) -c(OH-)=(10-3-10-11)mol·L-1。
(3)酸和碱加入水中对水的电离有抑制作用,生成盐时,存在NH4+,水解,对水的电离有促进作用,加入100mLNaOH时正好生成正盐,水解程度最大,是a点;而b点需要多加入一些NaOH,因此c(Na+) >c(SO42-)>c(NH4+)>c(OH-)=c(H+)。
II.(1)pH=9时pc是HCO3-最高,浓度最大;(2)c(H+)增大后,CO2+H2O H2CO3
H2CO3 H++HCO3-平衡向左移动放出CO2,碳酸浓度保持不变,pc=3;(3)因为M2CO3
H++HCO3-平衡向左移动放出CO2,碳酸浓度保持不变,pc=3;(3)因为M2CO3 2M++CO32-,故Ksp=c2(M+)·c(CO32-), (1×10-5) 2·c(CO32-)=1×10-12,c(CO32-)=1×10-2 mol·L-1,故pc(CO32-)=2。
2M++CO32-,故Ksp=c2(M+)·c(CO32-), (1×10-5) 2·c(CO32-)=1×10-12,c(CO32-)=1×10-2 mol·L-1,故pc(CO32-)=2。
