(1)某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 | 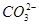 、 、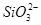 、 、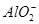 、Cl- 、Cl- |
| 阳离子 | Al3+、Cu2+、Mg2+、 、Na+ 、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y的体积(V)的关系如图所示。
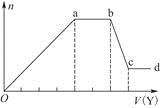
①若Y是盐酸,则溶液中含有的金属阳离子是____________________________,
ab段发生反应的总离子方程式为______________________________________,
表中Oa段与Y溶液反应的离子的物质的量之比为__________[要标明离子符号,如n(Na+)]。
②若Y是NaOH溶液,则bc段反应的离子方程式为
_________________________________________________________________。
若不考虑离子的水解因素,忽略H+和OH-的影响,且溶液中只存在4种离子,则它们的离子个数比为____________________________________________[按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列]。
(2)锡为第ⅣA族元素,锡的单质和化合物与某些物质的化学性质上有许多相似之处。已知锡元素具有如下性质:
Sn4++Sn=2Sn2+;
2Sn2++O2+4H+=2Sn4++2H2O;
2H++SnO Sn(OH)2
Sn(OH)2 Sn2++2OH-。
Sn2++2OH-。
试回答:
①锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的离子方程式:
___________________________________,________________________________。
②将①中溶液蒸干后继续加热所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是(分子式)__________。
③若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2, 该碱是__________。
(1)①Na+ 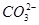 +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
n(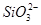 )∶n(
)∶n(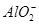 )=11∶2
)=11∶2
②Al(OH)3+OH-=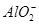 +2H2O
+2H2O
N(Al3+)∶N(Mg2+)∶N(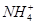 )∶N(Cl-)=2∶1∶4∶12
)∶N(Cl-)=2∶1∶4∶12
(2)①Sn+2H+=Sn2++H2↑
Sn2++Cl2=Sn4++2Cl-
②SnO2 ③NH3·H2O
(1)①若Y为盐酸,则Oa段反应为2H++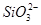 =H2SiO3↓、H++
=H2SiO3↓、H++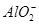 +H2O=Al(OH)3↓,ab段反应为2H++
+H2O=Al(OH)3↓,ab段反应为2H++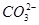 =H2O+CO2↑,bc段反应为Al(OH)3+3H+=Al3++3H2O;X溶液中含有
=H2O+CO2↑,bc段反应为Al(OH)3+3H+=Al3++3H2O;X溶液中含有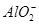 和
和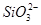 ,故阳离子中只有Na+可以存在;设bc段反应消耗的H+的物质的量为x,则根据bc段反应可得:n(
,故阳离子中只有Na+可以存在;设bc段反应消耗的H+的物质的量为x,则根据bc段反应可得:n(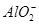 )=
)=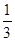 x,根据Oa段反应可得:n(
x,根据Oa段反应可得:n(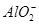 )+2n(
)+2n(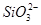 )=4x,解得n(
)=4x,解得n(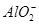 )∶n(
)∶n(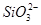 )=2∶11。②若Y为NaOH溶液,则Oa段反应为Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓,ab段反应为
)=2∶11。②若Y为NaOH溶液,则Oa段反应为Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓,ab段反应为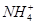 +OH-
+OH- NH3·H2O,bc段反应为Al(OH)3+OH-=
NH3·H2O,bc段反应为Al(OH)3+OH-=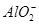 +2H2O;设bc段反应消耗的OH-的物质的量为y,则根据ab段反应可得n(
+2H2O;设bc段反应消耗的OH-的物质的量为y,则根据ab段反应可得n(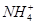 )=2y,根据bc段反应可得n(
)=2y,根据bc段反应可得n(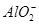 )=y,则根据元素守恒可知n(Al3+)=y,根据Oa段反应可得3n(Al3+)+2n(Mg2+)=4y,解得n(Mg2+)=y,根据电荷守恒可得n(Cl-)=6y,可得:n(Al3+)∶n(Mg2+)∶n(
)=y,则根据元素守恒可知n(Al3+)=y,根据Oa段反应可得3n(Al3+)+2n(Mg2+)=4y,解得n(Mg2+)=y,根据电荷守恒可得n(Cl-)=6y,可得:n(Al3+)∶n(Mg2+)∶n(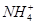 )∶n(Cl-)=2∶1∶4∶12。(2)①Sn的简单阳离子为Sn2+和Sn4+,可迁移铁与盐酸反应,其产物再与氯气反应的离子方程式;②FeCl3溶液蒸干后继续加热所得固体为Fe2O3,故SnCl4溶液蒸干后继续加热所得固体应为SnO2;③由2H++SnO
)∶n(Cl-)=2∶1∶4∶12。(2)①Sn的简单阳离子为Sn2+和Sn4+,可迁移铁与盐酸反应,其产物再与氯气反应的离子方程式;②FeCl3溶液蒸干后继续加热所得固体为Fe2O3,故SnCl4溶液蒸干后继续加热所得固体应为SnO2;③由2H++SnO Sn(OH)2
Sn(OH)2 Sn2++2OH-可知Sn(OH)2具有两性,故应用弱碱NH3·H2O和SnCl2反应制取Sn(OH)2以避免其与强碱反应。
Sn2++2OH-可知Sn(OH)2具有两性,故应用弱碱NH3·H2O和SnCl2反应制取Sn(OH)2以避免其与强碱反应。
