问题
选择题
(6分)常温下,浓度均为0.1mol·L-1的六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |
②根据表中数据,浓度均为0.01mol·L-1的下 * * 种物质的溶液中,酸性最强的
是 (填字母);将各溶液分别稀释100倍,pH变化最小的是 (填字母).
A.HCN B.HClO C.H2SO4 D.CH3COOH E.H2CO3
答案
.①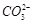 ②C A (每空2分)
②C A (每空2分)
解决此题要求学生对:1.盐类口水解的实质明确. 2.正确理解PH值的含义。
① 中:相同的条件下各种溶液都是为0.1mol/L 时,Na2CO3溶液碱性最大所以CO32--水解的程度最大(结合水给出的质子的能力最大),根据:水解规律:趆弱趆水解。
② C项硫酸为二元强酸,0.01 mol/L的硫酸中氢离子浓度为:0.02 mol/L 因此其酸性最强。第二空中选A 因为:HCN为其中最弱的酸。加水稀释对其电离平衡影响最小。
