(10分)现有常温下的0.1 mol/L纯碱溶液。
(1)你认为该溶液呈碱性的原因是(用离子方程式表示):_____________________。
为证明你的上述观点,请设计一个简单的实验,简述实验过程:
____________________________________________________________________。
(2)同学甲认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-不超过其总量的10%。请你设计实验证明该同学的观点是否正确_____________________________。
(3)同学乙就该溶液中粒子之间的关系写出了下列四个关系式,你认为其中正确的是 ________。
A.c(Na+)=2c(CO32-)
B.c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3)
C.c(CO32-)+c(HCO3-)=0.1 mol/L
D.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)(4)水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kh表示),请写出Na2CO3第一步水解反应的水解常数的表示式:________________________。
(10分)(每空2分) (1)CO32-+H2O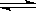 HCO3-+OH- 向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点
HCO3-+OH- 向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点
(2)用pH试纸(或pH计)测常温下0.1 mol/L纯碱溶液的pH,若pH<12,则该同学的观点正确;若pH>12,则该同学的观点不正确
(3)BD (4)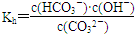
(1)呈碱性的原因是CO32―水解:CO32-+H2O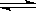 HCO3-+OH- 向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点
HCO3-+OH- 向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点
(2)要证明发生水解的CO32-不超过其总量的10%,用pH试纸(或pH计)测常温下0.1 mol/L纯碱溶液的pH,若pH<12,则该同学的观点正确;若pH>12,则该同学的观点不正确。
(3) BD正确,A不正确:电荷守恒c(Na+ )+c(H+ )= c(OH― )+2 c(CO32―)+c(HCO3―)
C不正确,物料守恒:c(Na+ )= c(CO32―)+c(HCO3―) +c(H2CO3)= 0.1 mol/L
将物料守恒物的式子代入电荷守恒可得c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),D正确;
CO32―分两步水解,以第一步为主,c(OH-)>c(HCO3-)>c(H2CO3),但水解的量很少,B正确。
(4) 由水解方程式:CO32-+H2O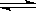 HCO3-+OH- 可得:
HCO3-+OH- 可得: