问题
填空题
某二元酸(化学式用H2A表示)在水中的电离方程式是(第一步电离完全):
H2A ="=" H+ + HA- HA-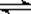 H+ + A2-
H+ + A2-
回答下列问题:
(1)Na2A溶液显____________(填“酸性”、“中性”、“碱性”)
理由是:(用离子方程式表示)__________________________________________。
(2)0.1mol/L的H2A溶液的pH_________1(填“<”“=”“>”)
(3)0.1mol/L的Na2A溶液中,下列微粒浓度关系错误的是_____________。
A.c(Na+) =2c(A2-) =" 0.2" mol/L
B.c(OH-) = c(H+) + c(HA-)
C.c(Na+) + c(H+) = c(OH-) + c(HA-) + 2c(A2-)
D.c(Na+) =" 2c" (A2-) + 2c (HA-)
答案
(1) 碱性,A2-+H2O 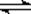 HA-+ OH- (2)< (3)A
HA-+ OH- (2)< (3)A
由电离方程式可知,Na2A属于强碱弱酸盐,水解显碱性,方程式为:A2-+H2O 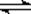 HA-+ OH-。H2A的第一步电离是完全电离,第二步电离是不完全电离,因此0.1mol/L的H2A溶液的pH小于1。Na2A属于强电解质在溶液中完全电离,方程式为Na2A=2Na++A2-,电离出的A2-发生水解A2-+H2O
HA-+ OH-。H2A的第一步电离是完全电离,第二步电离是不完全电离,因此0.1mol/L的H2A溶液的pH小于1。Na2A属于强电解质在溶液中完全电离,方程式为Na2A=2Na++A2-,电离出的A2-发生水解A2-+H2O 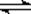 HA-+ OH-。因此选项A是错误的。B、C、D分别属于质子守恒、电荷守恒和物料守恒,均正确。
HA-+ OH-。因此选项A是错误的。B、C、D分别属于质子守恒、电荷守恒和物料守恒,均正确。
