(1)、相同物质的量浓度下的各溶液:NaX、NaY、NaZ,其PH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序为:
(2)、将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是
(3)、写出Na2CO3溶于水后的电离方程式: __________________________________________________________________
(4)、写出氯化铁溶液水解反应的离子方程式,并判断溶液的酸碱性:_____________________________________________________________溶液显________性
(9分)(1)HX>HY>HZ (2)Al2O3 (3)Na2CO3 =" 2" Na++ CO32-
(4)Fe3+ + 3H2O 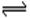 Fe (OH)3 + 3H+ 酸
Fe (OH)3 + 3H+ 酸
题目分析:(1)因pH越大,说明酸根离子水解越是强烈,对应的酸越弱.所以HX、HY、HZ的酸性由强到弱的顺序:HX>HY>HZ,故答案为:HX>HY>HZ;
(2)AlCl3是强酸弱碱盐,能水解生成氢氧化铝和氯化氢,AlCl3+3H2O⇌Al(OH)3+3HCl,HCl具有挥发性,所以在加热蒸发、蒸干,灼烧过程中挥发消失;灼烧Al(OH)3,Al(OH)3能分解生成氧化铝和水2Al(OH)3 Al2O3+3H2O,水在加热过程中蒸发掉,所以最后得到的白色固体是Al2O3,故答案为:Al2O3;
Al2O3+3H2O,水在加热过程中蒸发掉,所以最后得到的白色固体是Al2O3,故答案为:Al2O3;
(3)碳酸钠属于强电解质,溶于水后能完全电离:Na2CO3=2Na++CO32-,故答案为:Na2CO3=2Na++CO32-;
(4)三价铁离子的水解原理为:Fe3++3H2O⇌Fe(OH)3+3H+,故答案为:Fe3++3H2O⇌Fe(OH)3+3H+.
点评:本题重点考查学生盐的水解规律以及水解方程式的书写问题,注意知识的积累是解题关键,难度不大。
