问题
选择题
下列关于pH=12的Na2CO3溶液说法正确的是
A.升高溶液温度,溶液pH增大
B.c(Na+) +c(H+)=c(CO32-)+ c(HCO3-)+ c(OH-)
C.溶液中c(OH-)>c(HCO3-)> c(H+)
D.2c(Na+)=c(CO32-)+ c(HCO3-)+ c(H2CO3)
答案
AC
题目分析:碳酸钠是强碱弱酸盐,少部分碳酸根离子能够水解,即CO32—+H2O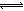 HCO3—+OH—,该水解反应是吸热反应,升高温度,促进碳酸根离子水解,氢氧根离子浓度增大,溶液的pH增大,故A选项正确;B项,违反电荷守恒原理,碳酸钠溶液中存在Na+、H+、CO32-、HCO3-、OH-,由于溶液呈电中性,则阳离子的正电荷总浓度等于阴离子的负电荷总浓度,即c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故B选项错误;碳酸根离子的水解分两步进行,CO32—+H2O
HCO3—+OH—,该水解反应是吸热反应,升高温度,促进碳酸根离子水解,氢氧根离子浓度增大,溶液的pH增大,故A选项正确;B项,违反电荷守恒原理,碳酸钠溶液中存在Na+、H+、CO32-、HCO3-、OH-,由于溶液呈电中性,则阳离子的正电荷总浓度等于阴离子的负电荷总浓度,即c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故B选项错误;碳酸根离子的水解分两步进行,CO32—+H2O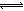 HCO3—+OH—,HCO3—+H2O
HCO3—+OH—,HCO3—+H2O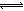 H2CO3+OH—,第一步水解程度大于第二步水解,碳酸钠溶液呈碱性,则溶液中c(OH-)>c(HCO3-)> c(H+),故C选项正确;D项,违反物料守恒原理,因为碳酸钠中钠离子是碳酸根离子的2倍,则平衡时溶液中c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故D选项错误。
H2CO3+OH—,第一步水解程度大于第二步水解,碳酸钠溶液呈碱性,则溶液中c(OH-)>c(HCO3-)> c(H+),故C选项正确;D项,违反物料守恒原理,因为碳酸钠中钠离子是碳酸根离子的2倍,则平衡时溶液中c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故D选项错误。
