问题
选择题
下列反应的离子方程式,正确的是 [ ]
A.向氯化铝溶液中加入过量氨水溶液:Al3++4OH- = AlO2-+2H2O
B.单质铜与稀硝酸反应:Cu+2H++2NO3- = Cu2++2NO↑+H2O
C.氯化铵溶液与氢氧化钠浓溶液混合并加热: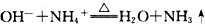
D.向硅酸钠溶液中滴加稀醋酸:SiO32-+2H+ = H2SiO3↓
答案
答案:C
下列反应的离子方程式,正确的是 [ ]
A.向氯化铝溶液中加入过量氨水溶液:Al3++4OH- = AlO2-+2H2O
B.单质铜与稀硝酸反应:Cu+2H++2NO3- = Cu2++2NO↑+H2O
C.氯化铵溶液与氢氧化钠浓溶液混合并加热: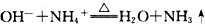
D.向硅酸钠溶液中滴加稀醋酸:SiO32-+2H+ = H2SiO3↓
答案:C