下列说法正确的是( )
A.0.01mol/L的Na2HPO4溶液中存在如下的平衡:HPO42-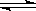 H++PO43-,加水稀释,使溶液中的HPO42-、H+、PO43-的浓度均减小
H++PO43-,加水稀释,使溶液中的HPO42-、H+、PO43-的浓度均减小
B.饱和NH4Cl溶液中:c(H+)+c(Cl-)=c(NH4+)+2c(NH3•H2O)+c(OH-)
C.常温下,0.01mol/L的 HA和BOH两种溶液,其pH值分别为3和12,将两溶液等体积混和后,所得溶液的pH≦7
D.在NH4HSO3溶液中,c(NH4+)= c(SO32-)+ c(HSO3-)+ c(H2SO3)
答案:B
题目分析:A对于HPO42-,水解大于电离。水解是溶液显碱性:H2O+HPO42-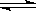 OH-+H2PO4-,加水时对溶液起到了稀释作用。最终使溶液中的Na+、HPO42-、OH-、PO43-的浓度均减小,但H+浓度增大。错误。B根据物料守恒可得:C(Cl-)=C(NH4+)+C(NH3·H2O).根据质子守恒可得:C(H+)=C(NH3·H2O)+C(OH-).将两式相加可得c(H+)+c(Cl-)=c(NH4+)+2c(NH3•H2O)+c(OH-)正确。C.常温下,0.01mol/L的 HA的溶液pH值分别为3,说明HA是弱酸。0.01mol/L的BOH溶液,PH值是12。则BOH是强碱。将两溶液等体积混和后,二者恰好反应生成强碱弱酸盐。盐水解是溶液显碱性,所以所得溶液的pH≥7。错误。D根据物料守恒可得c(NH4+)+c(NH3•H2O)= c(SO32-)+ c(HSO3-)+ c(H2SO3)。错误。
OH-+H2PO4-,加水时对溶液起到了稀释作用。最终使溶液中的Na+、HPO42-、OH-、PO43-的浓度均减小,但H+浓度增大。错误。B根据物料守恒可得:C(Cl-)=C(NH4+)+C(NH3·H2O).根据质子守恒可得:C(H+)=C(NH3·H2O)+C(OH-).将两式相加可得c(H+)+c(Cl-)=c(NH4+)+2c(NH3•H2O)+c(OH-)正确。C.常温下,0.01mol/L的 HA的溶液pH值分别为3,说明HA是弱酸。0.01mol/L的BOH溶液,PH值是12。则BOH是强碱。将两溶液等体积混和后,二者恰好反应生成强碱弱酸盐。盐水解是溶液显碱性,所以所得溶液的pH≥7。错误。D根据物料守恒可得c(NH4+)+c(NH3•H2O)= c(SO32-)+ c(HSO3-)+ c(H2SO3)。错误。
