已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3。
(1)在铜盐溶液中Cu2+发生水解反应的离子方程式为____,该反应的平衡常数为____;(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3/L3)
(2)根据H3PO3的性质可推测Na2HPO3稀溶液的pH______7(填“>”“<”或“=”)。常温下,向10mL0.01mol/L H3PO3溶液中滴加10ml0.02mol/LNaOH溶液后,溶液中各种离子浓度由大到小的顺序是_________;
(3)电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
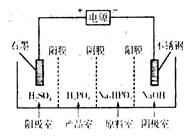
①阳极的电极反应式为____________________。
②产品室中反应的离子方程式为____________。
(13分)(1)Cu2++2H2O Cu(OH)2+2H+(2分);5×10-9(2分)
Cu(OH)2+2H+(2分);5×10-9(2分)
(2)>(2分);c(Na+)>c(HPO32-)>c(OH-)>c(H2PO3-)>c(H+)(2分)
(3)①4OH――4e-=2H2O+O2↑(2分)
②HPO32-+2H+=H3PO3(2分)或HPO32-+H+=H2PO3-、H2PO3-+H+=H3PO3(各1分)
题目分析:(1)氢氧化铜是弱碱,所以铜离子可以水解,溶液显酸性,其水解反应的离子方程式为Cu2++2H2O Cu(OH)2+2H+。化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以该反应的平衡常数K=
Cu(OH)2+2H+。化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以该反应的平衡常数K=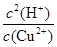 =
=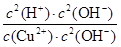 =
=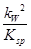 =
=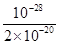 =5×10-9。
=5×10-9。
(2)H3PO3是弱酸,Na2HPO3是强碱弱酸盐,所以HPO32-水解,其水溶液呈碱性,即pH>7;向10mL0.01mol/LH3PO3溶液中滴加10ml 0.02mol/LNaOH溶液后,二者恰好反应生成Na2HPO3,溶液水解显碱性,所以溶液中离子浓度大小为c(Na+)>c(HPO32-)>c(OH-)>c(H2PO3-)>c(H+)。
(3)①电解池阳极失去电子,发生氧化反应,阴极得到电子发生还原反应。所以根据装置图可知,阳极上氢氧根离子失电子发生氧化反应,电极反应式为4OH――4e-=2H2O+O2↑。
②由于阳膜只允许阳离子通过,阴膜只允许阴离子通过,所以产品室中HPO32-和氢离子结合生成亚磷酸,反应离子方程式为HPO32-+2H+=H3PO3,或HPO32-+H+=H2PO3-、H2PO3-+H+=H3PO3。
