下列有关电解质溶液中微粒浓度关系不正确的是
A.0.lmol/LpH=4的NaHA溶液中: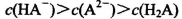
B.1mol/L的NaHCO3溶液中:
C.常温下,pH=7的NH4Cl与氨水的混合溶液中: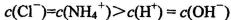
D.等体积、等物质的量浓度的NaX和弱酸HX的混合溶液中: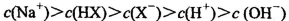
答案:D
题目分析:A.0.lmol/L的NaHA溶液,pH=4,则C(H+)=10-3mol/L<0.lmol/L.说明H2A为弱酸,NaHA是强酸弱碱盐,由于pH=4,,说明HA-的电离大于水解,所以C(H+)>C(OH-),C(A2-) > C(H2A)。但是弱酸根离子的水解或或电离作用是很微弱的。故这几种离子的浓度大小关系是:C(HA-)> C(A2-) > C(H2A)。正确。B.1mol/L的NaHCO3溶液中:根据物料守恒可知:C(Na+)=C(HCO3-)(始)= C(HCO3-)+C(CO32-)+C(H2CO3).正确。C.常温下由于混合溶液的pH=7=10-7mol/L,所以C(H+)=C(OH-),根据电荷守恒可得:C(H+)+C(NH4+) = C(OH-)+C(Cl-),所以C(NH4+)=C(Cl-)。溶液中盐的浓度远远大于水电离产生的氢离子或氢氧根离子的浓度。所以C(NH4+)=C(Cl-)> C(H+)=C(OH-)。正确。D.等体积、等物质的量浓度的NaX和弱酸HX的混合。即n(NaX)=n(HX).可能存在弱酸HX的电离作用大于NaX的水解作用,也可能存在HX的电离作用小于NaX的水解作用。若电离>水解,则各种离子的浓度关系是:C(X-)>C(Na+)>C(HX)>C(H+)>C(OH-);若水解>电离,则各种离子的浓度关系是:C(HX) >C(Na+)> C(X-) > C(OH->)C(H+).故错误。
