A、B、C、D分别是HNO3、Ba(NO3)2、NH4Cl、NaOH四种溶液中的一种。欲将它们一一鉴别,甲、乙、丙分别提出如下方案,请回答有关问题:
(1)甲同学用物质X一次性鉴别上述四种物质,他将适量的X溶液分别加入到四种溶液中,结果发现:C溶液变为棕黄色;B溶液中有白色沉淀产生;D溶液中有能使湿润的红色石蕊试纸变蓝的气体产生,同时产生白色沉淀,最终变为红褐色。
B的化学式是________;D的电子式是________;X的化学式是________;A溶液中水的电离程度________(填“大于”、“小于”或“等于”)C溶液中水的电离程度。
(2)乙同学提出用明矾来鉴别上述四种物质,写出能检验出NH4Cl溶液所涉及的所有离子方程式:Ba2++SO42-=BaSO4↓、________________________。
(3)丙同学用MgSO4来鉴别上述四种溶液,在生成的白色沉淀Mg(OH)2中分别加入HNO3和NH4Cl溶液时,发现沉淀均溶解。有以下两种解释,同时提供下表数据:
A.NH4Cl溶液能使Mg(OH)2溶解,主要是NH4+水解产生H+的缘故。
B.NH4Cl溶液能使Mg(OH)2溶解,主要是NH4+结合OH-的缘故。
| 0.01 mol·L-1 电解质溶液 | HF | CH3COOH | HCN | NH3·H2O |
| 酸中H+或碱 中OH-的浓度/mol·L-1 | 8.00×10-4 | 1.32×10-4 | 1.00×10-4 | 1.33×10-4 |
若要证明A和B哪一种解释正确,可以在生成的Mg(OH)2沉淀中加入一种物质,这种物质的化学式为__________________。
(1)Ba(NO3)2 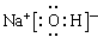 (NH4)2Fe(SO4)2 大于
(NH4)2Fe(SO4)2 大于
(2)Al3++4OH-=AlO2-+2H2O、NH4++OH-=NH3↑+H2O
(3)CH3COONH4
(1)白色沉淀最终变为红褐色,说明X中含有Fe2+,有能使湿润的红色石蕊试纸变蓝的气体产生,说明X中含有NH4+。X中不能只含有阳离子,因此结合“白色沉淀”推断X中含有SO42-。综上,X是(NH4)2Fe(SO4)2。稀硝酸与X反应时,只有Fe2+被氧化。根据题意可确定A、B、C、D依次是NH4Cl、Ba(NO3)2、HNO3、NaOH。NH4Cl水解促进水的电离,而HNO3电离出的氢离子抑制水的电离,故前者的电离程度大于后者。(2)分别加入少量明矾,有白色沉淀产生的溶液是Ba(NO3)2,有沉淀生成但立即溶解的溶液是NaOH。再将NaOH加入到另外两种溶液中,有刺激性气体产生的是NH4Cl溶液。据此即可写出涉及的所有离子方程式。(3)A、B发生分歧的焦点是:A认为NH4+水解使溶液呈酸性,与Mg(OH)2发生酸碱中和反应使其溶解;而B认为Mg(OH)2的溶解是由于铵盐电离出来的NH4+结合了Mg(OH)2电离出来的OH-,使其电离平衡正向移动,从而使其溶解。因此我们可以选择一种含有NH4+但呈中性的盐溶液,观察Mg(OH)2固体能不能溶解,如果能,则B正确;如果不能,则A正确。根据表格中的数据,等浓度的CH3COOH溶液中H+的浓度和NH3·H2O中OH-的浓度几乎相等,根据水解规律,CH3COONH4溶液应呈中性。
