已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+)·c(OH-)=________。
(2)各取5 mL上述溶液,分别加水稀释至50 mL,pH较大的是________溶液。
(3)各取5 mL上述溶液,分别加热到90℃,pH较小的是________溶液。
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液________;NH4Cl溶液________。
(5)取5 mL NH4Cl溶液,加水稀释至50 mL,c(H+)________10-6 mol·L-1(填“>”、“<”或“=”),c(NH4+)/c(H+)________(填“增大”、“减小”或“不变”)
(1)1×10-14 (2)H2SO4 (3)NH4Cl (4)1×10-9 mol/L 1×10-5 mol/L (5)> 减小
(1)在室温时,水的离子积常数为1×10-14。
(2)加水稀释后H2SO4溶液中H+直接稀释,而NH4Cl溶液中NH4++H2O NH3·H2O+H+平衡右移,溶液中H+被稀释同时,又增加,故pH较大的是H2SO4溶液。
NH3·H2O+H+平衡右移,溶液中H+被稀释同时,又增加,故pH较大的是H2SO4溶液。
(3)升高温度促进NH4+的水解,H+浓度增大,故pH较小的是NH4Cl溶液。
(4)由水电离的c(H+)等于由水电离出的c(OH-),故H2SO4溶液中由水电离出的c(H+)=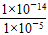 =10-9 mol/L,NH4Cl溶液中水电离出的c(H+)=1×10-5 mol/L。
=10-9 mol/L,NH4Cl溶液中水电离出的c(H+)=1×10-5 mol/L。
(5)加水稀释后使平衡NH4++H2O NH3·H2O+H+右移,故c(H+)>10-6 mol/L,
NH3·H2O+H+右移,故c(H+)>10-6 mol/L,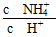 减小。
减小。
