问题
单项选择题
将一定质量的铁、氧化铁、氧化铜混合物粉末放入100mL4.4mol/L盐酸中,充分反应产生896mL(标准状况)气体后,残留固体1.28g,过滤,滤液中无Cu2+,将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L,则混合物中单质铁的质量是().
A.2.24g
B.3.36g
C.5.60g
D.10.08g
答案
参考答案:C
解析:
既然还有较多H+剩余,且滤液中没有Cu2+,可知残留物巾没有Fe,只有Cu。残留物中有Cu说明溶液中没有Fe3+,阳离子为H+和Fe2+。反应有:CuO+2H+====Cu2++H2O,Fe2O3+6H+====2Fe3++3H2O,Fe+2H+====Fe2++H2↑,Fe+2Fe3+====3Fe2+,Fe+Cu2+====Fe2++Cu。根据原子守恒和得失电子总数相等计算。设原有Fe为xmol,Fe2O3为ymol,CuO为zmol,生成Cu为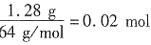 ,生成H2为
,生成H2为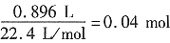 ,根据得失电子总数相等知:2x=2y+2×0.02+2×0.04;2(x+2y)+0.2×0.400=0.1×4.40。联立解出:x=0.1,y=0.04。原混合物中单质铁的质量56g/mol×0.1mol=5.60g。故本题选C。
,根据得失电子总数相等知:2x=2y+2×0.02+2×0.04;2(x+2y)+0.2×0.400=0.1×4.40。联立解出:x=0.1,y=0.04。原混合物中单质铁的质量56g/mol×0.1mol=5.60g。故本题选C。
