问题
选择题
Mg(OH)2在水中达到溶解平衡:Mg(OH)2(s) Mg2++2OH-,下列哪种情况可使Mg(OH)2(s)的量减少( )
Mg2++2OH-,下列哪种情况可使Mg(OH)2(s)的量减少( )
A.加入MgCl2溶液
B.加入少量NaOH
C.加入NH4NO3溶液
D.加入K2S溶液
答案
答案:C
A使[Mg2+]增大,B使[OH-]增大,均使平衡逆向移动,Mg(OH)2(s)的量增加,加入K2S溶液,S2-水解呈碱性,抑制Mg(OH)2固体溶解;加入NH4NO3,NH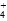 与OH-结合生成NH3·H2O,使[OH-]减小,平衡向右移动,促进Mg(OH)2(s)溶解。
与OH-结合生成NH3·H2O,使[OH-]减小,平衡向右移动,促进Mg(OH)2(s)溶解。
