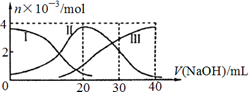
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图, 根据图示判断,下列说法正确的是
A.H2A在水中的电离方程式是:H2A  H+ + HA-;HA—
H+ + HA-;HA—  H+ + A2-
H+ + A2-
B.当V(NaOH)=20mL时,则有:c(Na+) > c(HA-) > c(H+) > c(A2-) > c(OH-)
C.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水小
D.当V(NaOH)=30mL时,则有:2c(H+) + c(HA-) + 2c(H2A) = c(A2-) + 2 c(OH-)
BC
题目分析:由图像可知溶液中存在H2A 、HA—、A2-三种微粒。所以H2A为二元弱酸。Ⅰ为H2A的变化曲线;Ⅱ为HA-的变化曲线;Ⅲ为A2-的变化曲线。H2A在水中的电离方程式是:H2A  H+ + HA-;HA—
H+ + HA-;HA— H+ + A2-。错误。B.当V(NaOH)=20mL时,恰好发生反应NaOH+ H2A=NaHA+H2O.根据物料守恒可得c(Na+) =c(H2A)+c(HA-)+c(A2-).因此c(Na+) > c(HA-)。在加入NaOH溶液20ml前HA-已经大量存在而且随NaOH体积的增大而增多,说明HA-的电离作用大于水解作用。所以c(H+) > c(OH-) 。因为在溶液中除了HA-电离产生H+,水也电离产生H+。所以c(H+) > c(A2-)。强电解质的电离作用远大于弱电解质的电离,所以c(HA-) > c(H+)。因此c(Na+) > c(HA-) > c(H+) > c(A2-) > c(OH-)。正确。C. 等体积等浓度的NaOH溶液与H2A溶液混合后得到NaHA.由于HA-的电离作用大于水解作用,所以溶液显酸性。HA-电离产生的H+对水的电离平衡H2O
H+ + A2-。错误。B.当V(NaOH)=20mL时,恰好发生反应NaOH+ H2A=NaHA+H2O.根据物料守恒可得c(Na+) =c(H2A)+c(HA-)+c(A2-).因此c(Na+) > c(HA-)。在加入NaOH溶液20ml前HA-已经大量存在而且随NaOH体积的增大而增多,说明HA-的电离作用大于水解作用。所以c(H+) > c(OH-) 。因为在溶液中除了HA-电离产生H+,水也电离产生H+。所以c(H+) > c(A2-)。强电解质的电离作用远大于弱电解质的电离,所以c(HA-) > c(H+)。因此c(Na+) > c(HA-) > c(H+) > c(A2-) > c(OH-)。正确。C. 等体积等浓度的NaOH溶液与H2A溶液混合后得到NaHA.由于HA-的电离作用大于水解作用,所以溶液显酸性。HA-电离产生的H+对水的电离平衡H2O H++OH-起到了抑制作用。所以其溶液中水的电离程度比纯水小。正确。D. 当V(NaOH)=30mL时,溶液为NaHA与Na2A等物质的量的混合物。根据电荷守恒可得①c(Na+)+ c(H+)= 2c(A2-) + c(OH-)+ c(HA-).根据物料守恒可得②2c(Na+)=3c(H2A)+3 c(HA-)+3c(A2-)。将①整理代入②,可得2c(H+) + c(HA-) + 3c(H2A) = c(A2-) + 2 c(OH-)。错误。
H++OH-起到了抑制作用。所以其溶液中水的电离程度比纯水小。正确。D. 当V(NaOH)=30mL时,溶液为NaHA与Na2A等物质的量的混合物。根据电荷守恒可得①c(Na+)+ c(H+)= 2c(A2-) + c(OH-)+ c(HA-).根据物料守恒可得②2c(Na+)=3c(H2A)+3 c(HA-)+3c(A2-)。将①整理代入②,可得2c(H+) + c(HA-) + 3c(H2A) = c(A2-) + 2 c(OH-)。错误。
