问题
填空题
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
某学习小组设计用如下图装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为______。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验: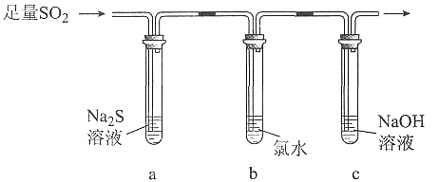
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是______(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为______。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)=______(用含硫微粒浓度的代数式表示)。)
答案
参考答案:
①试管a中出现淡黄色浑浊
②方案Ⅲ;
③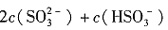
解析:
(1)反应中,Fe:+2→+3,S:-1→+4,即被氧化的元素是Fe和S。
设生成的二氧化硫的物质的量为8xmol,则生成三氧化二铁2xmol,由反应式可知:
5×8x+2×2x=2.75,解之得x=0.0625,所以生成的二氧化硫的物质的量为0.5mol,那么二氧化硫在标准状况下的体积为0.5mol×22.4L/mol=11.2L。
(2)④装置D增加的m g全是SO3,装置E产生的沉淀为BaSO4,则未转化的SO2的质量为
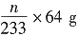 ,则转化的SO2的质量为
,则转化的SO2的质量为
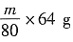 ,总SO2的质量为
,总SO2的质量为
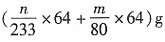 ,则转化率为
,则转化率为
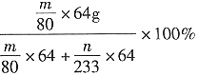 。
。