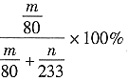问题
填空题
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)

①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是______。
②实验过程中,需要通入氧气。试写出一个用下图所示装置制取氧气的化学方程式______。
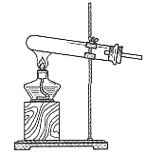
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是______。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是______(用含字母的代数式表示,不用化简)。
答案
参考答案:
①打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加
②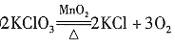 (其他合理即可)
(其他合理即可)
③使残留在装置中的二氧化硫和三氧化硫被充分吸收
④