问题
单项选择题
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是()。

A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中b、c两点对应的NaHSO3反应速率相等
C.图中a点对应的NaHSO3反应速率为5.0×10-5mol·L-1·s-1
D.温度高于40℃时,淀粉不宜用作该试验的指示剂
答案
参考答案:B
解析:
A项,40℃之前变蓝的速度加快,40℃之后溶液变蓝的速度减慢,即40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反;B项,虽然变蓝的时间一样,但是图中b、c两点对应阶段不同,所以图中b、c两点对应的NaHSO3反应速率不相等;C项,由题意知。c起始(NaHSO3)=0.02÷5=0.004mol·L-1,c末了(NaHSO3)=0mol·L-1,反应时间为80s。所以图中a点对应的NaHSO3反应速率为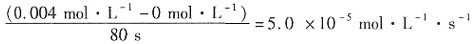 ;D项,温度高于40℃溶液变蓝时间增强,并且55℃时未观察到溶液变蓝,说明温度高于40℃时,淀粉不宜用作该试验的指示剂。
;D项,温度高于40℃溶液变蓝时间增强,并且55℃时未观察到溶液变蓝,说明温度高于40℃时,淀粉不宜用作该试验的指示剂。
